
Hans Andresen S. 1, Hermelinda Rivera G. 2
I. ANTECEDENTES
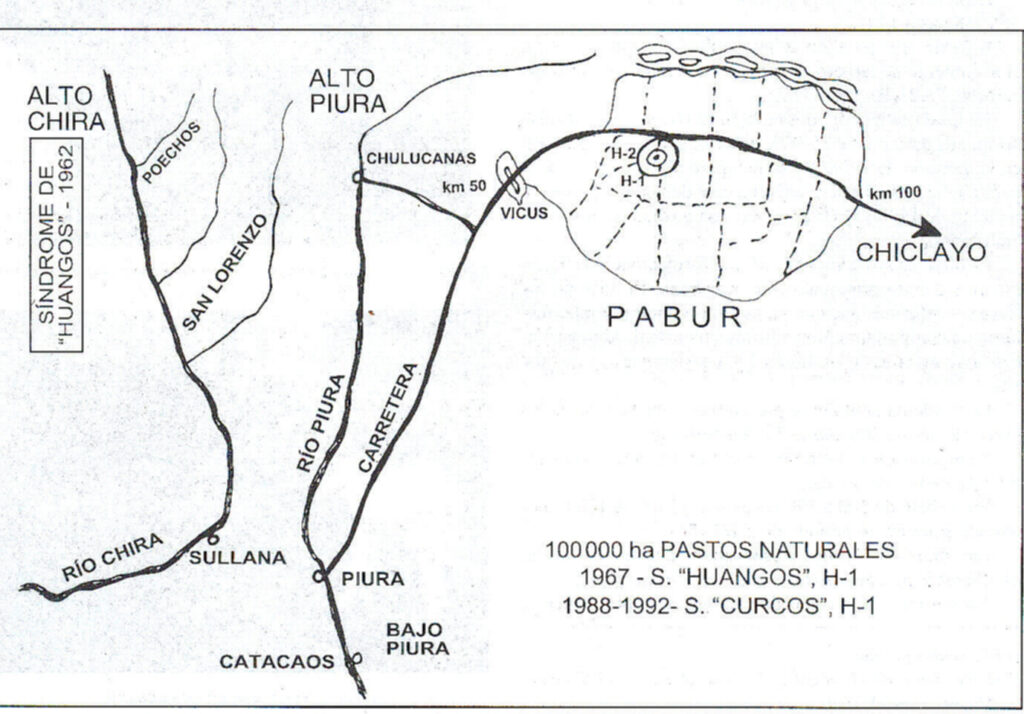
En 1962 se observó en el Alto Chira (Piura) el nacimiento de 90 terneros con malformaciones en un hato Gyr nativo de la región por más de 30 años. G. Ellis lo atribuyó a un factor hereditario por lo cual todos los toros fueron eliminados y reemplazados por otros de hatos vecinos, y el problema desapareció. Algunos años después, una parte de este hato fue trasladado a la finca H-2 en el centro de PABUR.
PABUR es un ecosistema aislado de 100 mil has de pastos naturales, dividido en 10 secciones, cada uno abastecido por una noria. PABUR mantenía en 1990 unas 20 mil cabezas de ganado cebú, de las cuales 5,600 vacas y una cantidad indeterminada de cabras.
En 1967, en la finca H-2, 15 vacas nativas de PABUR, que pastaban junto con las vacas Gyr procedentes del Alto Chira, parieron terneros deformes. Todo el hato fue eliminado y se formó un nuevo hato. Este hato se mantuvo normal durante más de 20 años.
II. NUESTRO REPORTE
El presente reporte abarca las observaciones hechas desde 1988 hasta 1991. A partir de la parición de noviembre de 1988 se reporta el nacimiento de terneros con malformaciones en todos los hatos de PABUR. De los datos recopilados en la finca H-2 se ve que la tasa normal de parición de 85-90% anterior a 1988, cayó a 60% en la parición de 1988/89, se recuperó algo (73,6%) en la parición de 1989/90 para volver a caer debajo de 60% en la parición de 1990/91. Estas caídas son atribuibles a muerte embrionaria. El 80% de los terneros con malformaciones nacieron muertos debido principalmente a distocia. El 35% de los terneros deformes nacidos vivos sobrevivieron y manifestaron un comportamiento neurológico normal. Algunas vacas tuvieron crías deformes en 2 y 3 gestaciones consecutivas.
El problema también se presentó en cabras; 12% de las crías nacidas de 200 cabras fueron deformes. Se registraron 174 terneros con malformaciones congénitas en menos de un año. En un hato de 200 a 300 vacas se registraron 120 terneros deformes en un período de 2 1/2 años. Las malformaciones observadas fueron: tortícolis, escoliosis y en algunos casos también artrogryposis. No se observaron casos de palatosquisis, prognatismo, braquignatismo ni defectos oculares de ninguna clase; lesiones que nos podrían haber sugerido una intoxicación por Lupinus spp., una infección por BVD o una deficiencia de vitamina A, entre otras causas. No se observó porencefalia, hidranencefalia ni hipoplasia cerebelar, lesiones que podrían habernos sugerido infecciones por virus Akabane, del VaIle de Caché, Lengua Azul, BVD u otros virus.

Nótese la avanzada tortícolis y depresión del costillar derecho.

El mismo ejemplar en otra postura

El primer ejemplar muestra tortícolis y depresión del costillar marcada escoliosis, tortícolis y artrogriposis.
No se encontraron plantas tóxicas en el rastreo que hicimos con un especialista en PABUR. Se estudiaron 200 sueros en el laboratorio de virología de la FMV de San Marcos (Lima) y una parte de éstos en Plume Island (USA).
Los resultados fueron negativos para los virus Akabane, Ibaraki, EHD, Maguari y Lengua Azul. En 13% de las muestras se detectó virus del Valle de Caché subtipo Playas; resultados que no guardan relación epidemiológica con el problema.
Tabla 1: Incidencia de Malformaciones Congénitas en PABUR
|
Hato
N°
|
Vacas
N°
|
Terneros
malformados
|
Período
observado
|
|
N°
|
%
|
|
H-2
|
200
|
74
|
43,8
|
Nov 88 – Set 89
|
|
H-1
|
400
|
9
|
3,3
|
Die 88 – Ene 89
|
|
H-3
|
400
|
5
|
25,0
|
Enero 89
|
|
H-4
|
160
|
30
|
28,0
|
Ene – Agto 89
|
|
N-1
|
160
|
5
|
55,0
|
Enero 89
|
|
Zap
|
480
|
14
|
n.d.
|
Die 88 – Ene 89
|
|
Poi
|
500
|
27
|
3,6
|
Die 88 – Ene 89
|
|
Hua
|
1000
|
10
|
1,0
|
Die 88 – Ene 89
|
Un hallazgo interesante fue que 95% de las muestras fueron positivas al virus de Encéfalomielitis Equina Venezolana (EEV) y 74% a la cepa 1600 del mismo virus. Esta cepa está relacionada con la cepa TC-83 de virus vacunal contra la EEV. Un virus relacionado con la cepa 1600 de EEV fue aislado por I. Phillips (NAMRID) y tipificado en Estados Unidos.
Lamentablemente no se pudo concluir la investigación para determinar si el virus aislado era o no responsable de las malformaciones congénitas de PABUR.
La sospecha de que el problema pudiese tener alguna base hereditaria no tiene ningún fundamento debido a que las características epidemiológicas del problema indican que se trata de una epizoótia compatible con agentes del medio ambiente (como tóxicos o infecciosos). Jamás un factor hereditario puede causar anomalías de la magnitud observada en PABUR.
Tabla 2: Incidencia de Malformaciones en H-2
Terneros
nacidos
|
Terneros malformados
|
Período
|
|
N°
|
%
|
|
31
|
12
|
38,7
|
Oct – Dic 88
|
|
25
|
18
|
72,0
|
Ene – Mz 89
|
|
44
|
31
|
70,4
|
Abr- Jun 89
|
|
25
|
10
|
40,0
|
Jul – Set 89
|
|
55
|
O
|
0,0
|
Oct – Dic 89
|
|
70
|
O
|
0,0
|
En – Mzo 90
|
|
51
|
17
|
33,0
|
Abr- Jun 90
|
|
38
|
12
|
31,6
|
Jul – Set 90
|
|
60
|
11
|
18,3
|
Oct – Dic 90
|
|
33
|
9
|
27,3
|
Ene – Mr 90
|
Interesante y sorprendente es que el problema desapareció de modo espontáneo con la llegada del Fenómeno del Niño en 1993. Sin embargo, parece que este síndrome es recurrente siendo probable que se vuelva a presentar de aquí a 2 décadas o antes, situación para la cual debemos estar preparados.
III. BIBLIOGRAFÍA
1 Andresen, H., Rivera, H., and Morales, c.- Congenital Malformations’ Syndrome in Cebu Cante in Peru. Proceedings XVII World Buiatrics Congress, 1992.
2. Ellis, G.- Research Report, 1963.
3. Balarezo, J.- Comunicación personal, 1989, 2000.
4. Phillips, 1 et al.- NAMRID Report, 1990.
5. Szabo, K.T.- Congenital Malformations in Laboratory and Farm Animals. Academic Press, 1989.
(1) Consultor privado
(2) Laboratorio de Virología-FMV, Universidad Nacional Mayor de San Marcos.
Fuente Autorizada para Perulactea.com: MV Rev. de Cien. Vet. Vol. 16 N° 1-2, 2000 Lima – Perú

 Artículos10 meses atrás
Artículos10 meses atrás
 Artículos11 meses atrás
Artículos11 meses atrás
 Noticias Nacionales10 meses atrás
Noticias Nacionales10 meses atrás
 Giras1 año atrás
Giras1 año atrás
 Cursos A Distancia1 año atrás
Cursos A Distancia1 año atrás
 Noticias Nacionales5 meses atrás
Noticias Nacionales5 meses atrás
 cursos on line10 meses atrás
cursos on line10 meses atrás
 Noticias Nacionales1 año atrás
Noticias Nacionales1 año atrás




















