La espiramicina es un antibiótico perteneciente al grupo de los macrólidos, efectivo contra bacterias grampositivas y micoplasma. Se caracteriza por su excepcional habilidad de concentrarse en los tejidos, dando como resultado una concentración de 25 a 60 veces más en tejidos que en suero. Al igual que los otros macrólidos, la espiramicina tiene un efecto directo sobre las células fagocíticas y como tal, un particular potencial contra organismos intracelulares (Steeve et al., 2013)
Los macrólidos son bases débiles cuyo pKa va de 6-9, y la mayoría de veces es superior a 8. Son compuestos con clara tendencia hacia un pH básico, que suele estar entre 7 y 8.8. Al igual que otros fármacos, su efecto es dependiente del pH del medio donde se deposita; presentando mayor actividad en medios ligeramente alcalinos, y se reduce en medios con pH por debajo de 7. Son eficaces en el tratamiento de infecciones por microorganismo resistentes a penicilinas, logrando una concentración intracelular alta. Son generalmente agentes bacteriostáticos pero pueden ser bactericidas en altas concentraciones (Steeve et al., 2013). Requieren de por lo menos cuatro veces la concentración mínima inhibitoria (CMI) para conseguir el efecto bactericida, la cual deberá mantenerse por lo menos por 3 horas para lograrlo. Lo anterior indica que estos antibióticos son tiempo-dependientes. Una vez que logran su efecto bacteriostático o bactericida presentan un efecto postantibiótico que va de 4 a 6 horas y que se debe en buena medida a su efecto inmunomodulador (Sumano, 2006), ya que los macrólidos inhiben la producción de citoquinas, teniendo un efecto moderador sobre la respuesta proinflamatoria (Altenburg et al., 2011). También inhiben la formación de leucotrieno B4, el cual atrae a los neutrófilos y bloquean la formación de moléculas de adhesión necesarias para la migración de los neutrófilos (Steeve et al., 2013).

Farmacocinética.- La farmacocinética de estos antibióticos son mejor descritos como un modelo de dos compartimentos. Las concentraciones en tejidos (compartimento periférico) son consistentemente más altos que en suero (compartimiento central). La mayoría del contenido periférico se sitúa en pulmón, hígado, riñón, bazo y el tracto reproductivo. La principal ventaja farmacocinética de la espiramicina es su excelente penetración tisular e intracelular (particularmente en macrófagos) a pesar de tener concentraciones séricas bajas (Anadón, 1999). Su acumulación en macrófagos proporciona un efecto postantibiótico prolongado. Se metaboliza en hígado; y se elimina principalmente por la bilis y sólo el 3% por la orina (Sumano, 2006).
Mecanismo de acción.- La espiramicina actúa bloqueando la síntesis de proteínas mediante inhibición de la traslocación por unión reversible a la subunidad ribosómica 50S de la bacteria (Botana, 2002). Se une progresiva y fuertemente a varios tejidos, permitiéndole alcanzar niveles intracelulares con un efecto bacteriostático primero y bactericida posteriormente superiores a la de los otros macrólidos. Su capacidad de llegar al interior de los macrófagos, permite que al migrar a las zonas infectadas por el mecanismo de defensa propio del organismo llevan consigo al fármaco, lo que contribuye al proceso de acumulación de éste en el sitio de infección y facilita la completa eliminación del patógeno (Sumano, 2006).
La espiramicina está indicada en vacunos, ovinos y caprinos para el tratamiento y control de neumonías, infecciones del tracto respiratorio, genitourinario y de los tejidos blandos. En un estudio realizado por Cester et al. (1990) se demostró el potencial uso de la espiramicina en el tratamiento de endometritis en ovejas.
Las enfermedades de la reproducción en el ganado bovino causan más pérdidas económicas que cualquier otro grupo de problemas de salud en la producción lechera, debido a la afectación del potencial genético, disminución de la producción de leche y por necesidad de aplicar tratamientos que elevan los gastos por concepto de medicamentos y servicios veterinarios. Entre las principales causas, las infecciones del tracto reproductor de la hembra, en especial, la contaminación del útero con microorganismos patógenos o potencialmente patógenos, posee una gran importancia (Fernandez et al., 2006). Siendo esta la causa más importante de infertilidad en vacas.
La infertilidad asociada con la infección uterina se produce por el daño del endometrio y alteración del ciclo ovárico, ya que la bacteria modula la secreción de prostaglandina endometrial y altera el crecimiento del folículo ovárico y su función (Sheldon et al., 2008)
La infección uterina, puede causar cervicitis, endometritis o metritis de diversos grados, que a su vez puede conducir a la muerte embrionaria y repetición en los servicios (Gani et al., 2008). La metritis séptica generalmente está asociada a la retención de membranas fetales o retención placentaria. La retención de membranas fetales se convierte en factor predisponente que resulta de suma importancia en el aumento a la susceptibilidad de metritis y piometra (Fernandez et al., 2006)
Según estudios realizados por Moges et al. (2013) las siguientes bacterias fueron aisladas en vacas con endometritis clínica.

La eficacia del tratamiento en las infecciones uterinas dependerá de la concentr200ación antimicrobiana alcanzada y el mantenimiento de la concentración mínima inhibitoria en el lugar de infección. En este aspecto, la disposición de los antimicrobianos en el tracto genital puede ser influenciada por muchos factores incluyendo la vía de administración. Según Cester et al. (1990), las concentraciones de muchos antibióticos son mayor, y mejor distribuidas en tejidos del tracto genital después de una administración sistémica que de una administración intrauterina. Así mismo demostró que después de la administración vía parenteral de Espiramicina en ovejas, esta alcanzó concentraciones suficientemente altas y persistentes en las secreciones del tracto genital, concluyendo que la Espiramicina es un antibiótico eficaz en el tratamiento de infecciones uterinas.
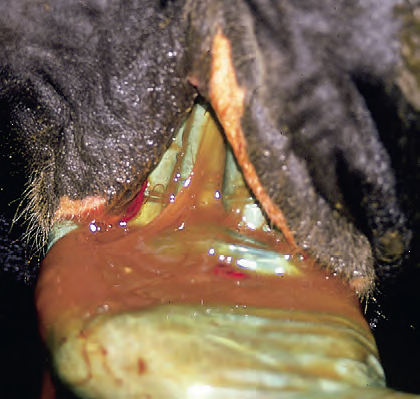
Descarga uterina marrón en Metritis
Fuente: Blowey, 2011
La Espiramicina también demostró ser eficaz contra bacterias aerobias grampositivas causantes de mastitis en vacas (Jousimies et al., 1996).
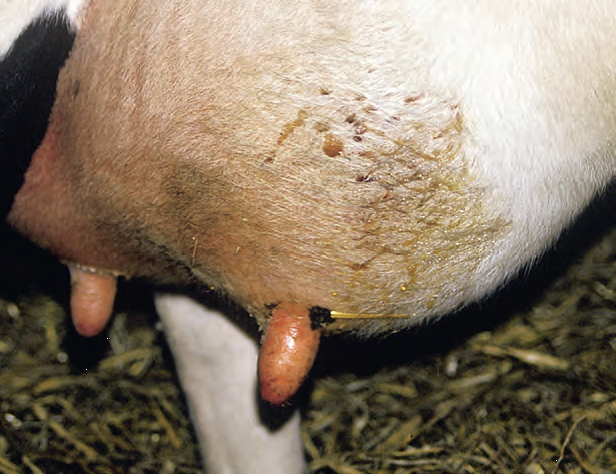
Mastitis. Cuarto agrandado con secreción serosa sobre piel.
Fuente: Blowey, 2011
Toxicidad.- Una característica común de los macrólidos es su naturaleza irritante; la mayoría provoca dolor agudo pasajero durante su administración intramuscular. En un estudio realizado por Zuheir y Abdaldayem (2012), se demostró que la espiramicina administrada en dosis terapéuticas en ovejas no ocasionó cambios hematológicos ni bioquímicos considerables, pudiendo ser utilizado de forma segura en tratamientos de las infecciones susceptibles a este antibiótico.
Por lo tanto la Espiramicina es un antibiótico indicado por sus múltiples ventajas como su alta capacidad de concentración, difusión y distribución en los tejidos infectados, así como su efecto postantibiótico lo que lo hace un antibiótico de elección en infecciones de tejidos profundos.
ESPIRAMIC , indicado en bovinos, ovinos ,caprinos y porcinos para la prevención y tratamiento de cuadros infecciosos provocados por gérmenes Gram positivos, Gram negativos, Micoplasmas, y Rickettsias causantes de gastroenteritis infecciosa, onfalitis, neumopatías, infecciones oculares, mastitis, metritis, septicemia, actinomicosis, anaplasmosis, artritis,etc. Está formulado para ser administrado por vía intramuscular profunda. En bovinos se recomienda una dosis de 1 mL por cada 20 kg de peso vivo, terneros 1 mL por cada 10 kg de peso vivo; ovinos y caprinos 1 mL cada 8 kg de peso vivo y porcinos 4 a 5 mL (lechones) y de 15-25 mL (adultos y reproductores).
Bibliografía
- Altenburg J., De Graff C., Van der Werf T., Boersma W. Inmunomodulatory effects of macrolide-part1: biological mechanisms. Respiration 2011;81:67–74
- Anadon A. 1999 Macrolide antibiotics, drug interactions and microsomal enzymes: implications for veterinry medicine. Research in Veterinary Science 66,197-203.
- Blowey R., Weaver D.2011.Color Atlas of diseases and disorders of cattle. Third edition. Mosby Elseiver. Pág.: 113
- Botana L., Landoni M., Jimenez T. 2002. Farmacología y Terapéutica Veterinaria. Editorial McGraw-Hill Interamericana. Pág.: 478
- Cester C., Laurentie M.,García-Villar R., Toutain P. Spiramycin concentrations in plasma and genital-tract secretions after intravenous administration in the ewe. Journay of Veterinary Pharmacology and Therapeutics. Vol 13(1):7-14
- Fernandez A., Silveira E., Lopez O. 2006. Las infecciones uterinas en la hembra bovina. Revista Electrónica de Veterinaria (REDVET). Vol VII, Nº 10.
- Jousimies H., Pyorala S., Kanervo A.1996. Susceptibilities of Bovine Summer Mastitis Bacteria to Antimicrobial Agents. Antimicrobial agents and chemotherapy. Pág.: 157–160
- Gani M., Amin M., Alam M., Kayesh M. Karim M., Samada A., Islam R. 2008. Bacterial flora associated with repeated breeding and uterine infections in dairy cows. Bangladesh Journal of Veterinary Medicine. 6(1):79-86.
- Moges N., Regassa F., Yilma T., Unakal Ch.2013. Isolation and Antimicrobial Susceptibility of Bacteria from Dairy Cows with Clinical Endometritis. Journal of Reproduction and Infertility 4(1): 04-08
- Renard L., Sanders P., Laurentie M., Delmas J.1996. Pharmacokinetic-pharmacodynamic model for spiramycin in staphylococcal mastitis. Journal of Veterinary and Pharmacology Therapeutics. 19(2):95-103.
- Sheldon I., Williams E., Miller A., Nash D., Herath N. 2008. Uterine diseases in cattle after parturition. The Veterinary Journal 176. Pág.: 115-1121.
- Steeve J., Prescott J.,Dowling P.2013. Antimicrobial therapy in Veterinary Medicine. 5ta edición, Editorial Wiley Blackwell. Pag. 165-167
- Sumano H., Ocampo L. 2006. Farmacología Veterinaria. 3ra edición. McGraw-Hill Interamericana.Pág.:139
- Zuheir I., Abdaldayem M.2012. The effect of intramuscular injection of spiramycin at therapeutic dose on some blood biochemical and hematological parameters in Assaf sheep. Scientific Journal of Veterinary Advances 1(6) 142-146
Elaborado por:
[fresh_button url=»http://www.totalvet.com.pe/» size=»large» color=»red» target=»_blank» class=»»]TOTALVET[/fresh_button]

 Artículos10 meses atrás
Artículos10 meses atrás
 Artículos11 meses atrás
Artículos11 meses atrás
 Noticias Nacionales10 meses atrás
Noticias Nacionales10 meses atrás
 Giras1 año atrás
Giras1 año atrás
 Cursos A Distancia1 año atrás
Cursos A Distancia1 año atrás
 Noticias Nacionales5 meses atrás
Noticias Nacionales5 meses atrás
 cursos on line10 meses atrás
cursos on line10 meses atrás
 Noticias Nacionales1 año atrás
Noticias Nacionales1 año atrás

















1 comentario