PhD. Luis F. Calvinho*. Instituto Nacional de Tecnología Agropecuaria – INTA (Argentina)
La mastitis es la inflamación de la glándula mamaria, generalmente causada por agentes microbianos. Esta enfermedad es uno de los limitantes más importantes de la producción lechera en todo el mundo. Se estima que debido a la menor producción de leche, los mayores costos por descarte prematuro de animales, los costos de antibióticos, la leche descartada debido a tratamientos antibióticos, los costos por servicios veterinarios y el trabajo extra, la capacidad productiva anual disminuye del 10 al 11% (Bramley et al., 1996).
La mastitis es una enfermedad multicausal, habiéndose identificado más de 80 agentes etiológicos, incluyendo especies de bacterias, hongos, mycoplasmas y algas. Los organismos que producen mastitis han sido clasificados en patógenos contagiosos y ambientales de acuerdo con sus distintas características de distribución e interacción con la piel y el canal del pezón. Los patógenos contagiosos necesitan vivir y multiplicarse sobre y dentro de la glándula mamaria bovina y se transmiten de un animal a otro principalmente durante el ordeño (Fox & Gay, 1993), mientras que los patógenos ambientales son aquellos cuyo reservorio primario es el ambiente donde viven las vacas y no las glándulas mamarias infectadas (Smith & Hogan, 1997). Dentro de los patógenos contagiosos se incluyen Staphylococcus aureus, Streptococcus agalactiae, especies de Mycoplasma y Corynebacterium bovis, mientras que los patógenos ambientales incluyen un heterogéneo grupo de géneros y especies bacterianas entre las que se destacan principalmente Streptococcus uberis y los organismos coliformes. Otros organismos, como Streptococcus
dysgalactiae, pueden comportarse tanto como patógenos contagiosos como ambientales (Fox & Gay, 1993; Smith & Hogan, 1997).
La condición multietiológica de la mastitis bovina y la ubicuidad de algunos microorganismos en el ambiente hacen imposible la erradicación de la enfermedad, pero se cuenta con diversas medidas que, utilizadas en forma conjunta pueden asegurar su control. Los métodos actuales de control de mastitis fueron desarrollados hacia fines de la década del 60 y están basados en la prevención de las nuevas infecciones intramamarias (IIM) y el acortamiento de las IIM presentes en el rodeo (Booth, 1975). Los programas de control consisten en medidas de higiene durante el ordeño, incluyendo la desinfección de pezones, terapia antibiótica y descarte de animales con IIM crónicas. La terapia antibiótica es uno de los pilares de los programas de control, utilizándose para el tratamiento tanto de casos clínicos como subclínicos. En general, los casos clínicos son tratados durante la lactancia, mientras que los subclínicos al inicio del período de involución mamaria. En este período, también llamado etapa de vaca seca, se produce un incremento de la susceptibilidad de la vaca a las IIM (Oliver & Sordillo, 1988), lo que ha determinado la búsqueda de estrategias que refuercen la actividad de la terapia antibiótica clásica. A continuación se revisan los fundamentos de la administración de terapia antibiótica durante la etapa de vaca seca, su eficacia y sus limitantes. Asimismo, se discutirán nuevas estrategias que se han desarrollado en los últimos años para lograr una mayor disminución del número de infecciones mamarias durante esta etapa, destacando el valor relativo de las mismas.
INVOLUCIÓN MAMARIA
El manejo actual de los animales lecheros determina que exista una superposición significativa entre lactancia y preñez; de forma tal que los animales están generalmente en estado de preñez cuando se interrumpe el ordeño en la lactancia tardía. Consecuentemente, cuando esto ocurre, el estímulo mamogénico y lactogénico de la preñez se opone a los estímulos para la involución mamaria (Capuco & Akers, 1999).
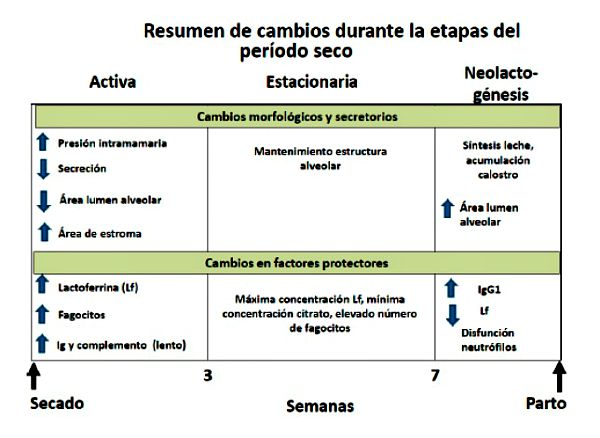
La duración del período no lactante influye en la producción de leche de la lactancia subsiguiente, considerándose necesario un período seco de 40 a 60 días para una óptima producción de leche (Bachman & Schairer, 2003). El período de involución activa dura de tres a cuatro semanas y, a pesar de haberse interrumpido el ordeño, la glándula mamaria continúa secretando leche con el consiguiente aumento de la presión intramamaria hasta el tercer día aproximadamente. Luego de la primera semana la producción láctea disminuye significativamente, comenzando a disminuir el volumen de leche, y por lo tanto la presión intramamaria, hasta llegar a niveles mínimos a los 30 días de interrumpida la lactancia. Al cuarto día de involución activa disminuye marcadamente la concentración de grasa, caseína, lactosa y citratos (Oliver & Sordillo, 1988; Sordillo & Nickerson, 1988). Durante este período comienzan a aumentar significativamente algunas proteínas defensivas, como la lactoferrina (Lf) e inmunoglobulinas, así como células del sistema inmune; sin embargo, la aparición de nuevas IIM se ve favorecida en esta etapa. Esto se debe fundamentalmente al gran volumen de leche acumulado, la falta de remoción de la leche y la escasa concentración de los componentes defensivos durante los primeros días de involución. El volumen de secreción es de unos pocos mililitros y los componentes lácteos se hallan en una concentración mínima, mientras que la concentración de Lf e inmunoglobulina es alta (Oliver & Sordillo, 1988; Sordillo & Nickerson, 1988).
Durante la involución de la glándula mamaria se producen cambios en la morfología tisular que responden a la falta de actividad secretoria. El aspecto más evidente es el mantenimiento de la estructura alveolar a lo largo del período seco. El área ocupada por estroma aumenta a un máximo a los 35 días de involución y disminuye a un mínimo a los 7 días preparto. A las 24 hs de interrumpida la lactancia se observa una reducción en la fusión de las vesículas secretorias con la membrana apical de las células epiteliales mamarias y un acúmulo de vesículas secretorias y gotitas de grasa dentro de las células alveolares (Holst et al., 1987; Sordillo & Nickerson, 1988). A medida que la producción disminuye, el tejido de la glándula mamaria involuciona. Como consecuencia de la activación de la plasmina, la caseína es desdoblada y los macrófagos eliminan los restos de tejidos. La superficie interna disminuye en la medida que el sistema alveolar mamario involuciona. A los 15 días de involución la mayoría de las células muestran una marcada reducción de su capacidad secretoria. Sin embargo, las células se mantienen viables y con capacidad para sintetizar algunos componentes como la Lf. A los 30 días el lumen alveolar es mínimo y las células epiteliales muestran pocas vacuolas (Oliver & Sordillo, 1988; Sordillo & Nickerson, 1988).
Entre los 20 y 15 días preparto comienza la neolactogénesis. Este es un período de transición donde predominan los procesos formativos; siendo la función prioritaria de la glándula la síntesis de caseína, grasa y lactosa y la acumulación de calostro. El número de células del sistema inmune comienza a descender, al igual que las proteínas defensivas, como la Lf; aunque la concentración de inmunoglobulinas (fuente de protección para el ternero) aumenta significativamente. A los 15 días preparto la proporción de células activas se incrementa y a los 7 días preparto casi todas las células alveolares muestran las características típicas que indican preparación para la síntesis y secreción (Holst et al., 1987; Sordillo & Nickerson, 1988). La glándula mamaria del bovino no tiene una pérdida neta importante de células durante la involución, como ocurre en otras especies animales (Capuco et al., 1997). Al aproximarse la fecha de parto, la acumulación de secreción, la falta de remoción de leche y el posible escurrido de leche a través del canal del pezón, favorecen la aparición de nuevas IIM. Se puede concluir que, tanto durante la transición de la lactancia a la involución, como durante el intervalo comprendido entre la involución y la calostrogénesis, la glándula mamaria bovina es altamente susceptible a las nuevas IIM. Por el contrario, la glándula totalmente involucionada es altamente resistente a las nuevas IIM (Oliver & Sordillo, 1988).
OBJETIVO DE LA TERAPIA ANTIMICROBIANA DE VACA SECA
El porcentaje de nuevas IIM durante el período seco puede variar desde un 3,8 a un 35,1% de cuartos infectados en vacas que no recibieron tratamiento con antimicrobianos al fin de la lactancia (Eberhart, 1986). Si bien las nuevas IIM pueden producirse durante todo el período de vaca seca, se ha determinado que el mayor número se produce durante las primeras tres semanas luego de interrumpida la lactancia y en la etapa inmediatamente anterior al parto (Eberhart, 1986; Oliver & Sordillo, 1988). Los organismos contagiosos pueden estar presentes en las glándulas al momento del secado, mientras que durante las primeras semanas de involución y en el preparto se incrementa la exposición a los organismos ambientales (Smith & Hogan, 1997). Este comportamiento determina que los esfuerzos para controlar las IIM deben concentrarse en el secado temprano y en el preparto. Consecuentemente, la terapia antimicrobiana se utiliza al inicio del período de secado para eliminar aquellas infecciones subclínicas presentes en ese momento y prevenir nuevas IIM que podrían presentarse durante la involución.
PREPARACIONES INTRAMAMARIAS
La terapia antibiótica para vaca seca en la actualidad implica, casi exclusivamente, el uso de la vía intramamaria con productos formulados en bases de liberación lenta (Jánosi & Huszenicza, 2001; Gruet et al., 2001). En trabajos precursores se demostró que, luego de la administración intramamaria de un antimicrobiano al final de la lactancia la disminución de la concentración de droga en las secreciones de vaca seca es de tipo exponencial, observándose diferencias en las tasas de absorción de distintos antimicrobianos, dependiendo de sus características físico-químicas (Ziv et al., 1973). Aquellos antimicrobianos con un mayor coeficiente de partición entre fase lípido-agua, así como los que se unen con mayor facilidad a proteínas de la secreción mamaria o del tejido mamario, fueron retenidos por mayor tiempo en la glándula mamaria al verse disminuida su absorción, consecuentemente minimizando la pérdida por difusión a la sangre (Ziv et al., 1973). Para los antibióticos frecuentemente utilizados, se considera que las concentraciones de la droga alcanzadas en las secreciones de vaca seca exceden las concentraciones mínimas inhibitorias halladas para la mayoría de los organismos causantes de mastitis, lo cual sería suficiente para lograr una concentración terapéutica efectiva durante la involución temprana de la glándula mamaria (Soback, 1988; Nickerson et al., 1999). Además, el uso de bases de liberación lenta en estas formulaciones, disminuye la tasa de absorción manteniendo una mayor concentración de antibiótico por mayor tiempo en las secreciones mamarias (Ziv et al., 1973, 1980; Gruet et al., 2001; Gehring & Smith, 2006). Los antibióticos más frecuentemente utilizados a nivel mundial para el tratamiento al secado son los beta lactámicos y macrólidos (Jánosi & Huszenicza, 2001; Gruet et al., 2001; Gehring & Smith, 2006).
EFICACIA DE LA TERAPIA ANTIMICROBIANA PARA VACA SECA
En general, la eficacia de la terapia antimicrobiana en infecciones mamarias depende de los siguientes factores (Soback, 1988; Ziv, 1992): (a) la concentración óptima de antibiótico durante un tiempo adecuado en el foco de infección; (b) la susceptibilidad de los microorganismos a los antimicrobianos; (c) la farmacodinamia de los antibióticos; (d) la dosis y la forma de administración; (e) el momento de realización de la terapia antibiótica (lactancia o inicio de período seco) y (f) el parasitismo intracelular, como es el caso de S. aureus.
La terapia antimicrobiana para vaca seca puede reducir en un 70 % el nivel de infección en el período que va del secado al parto, siendo más eficaz que el tratamiento durante la lactancia y permitiendo una mejor regeneración del tejido dañado (Eberhart, 1986). El tratamiento antibiótico de vaca seca elimina más del 85 % de las infecciones estreptocócicas y del 25 al 75% de las estafilocócicas (Eberhart, 1986; Sol et al., 1990). El tratamiento de IIM durante el período de vaca seca es más eficaz que durante la lactancia debido a que se obtiene una concentración de antibiótico en el sitio de infección más uniforme en el corto plazo por la falta de eyección de leche. Además, se pueden administrar mayores dosis de antimicrobianos que durante la lactancia y los costos son menores al no existir descarte de leche post tratamiento (Gruet et al., 2001).
[fresh_button url=»https://perulactea.com/2015/08/13/estrategias-de-control-de-infecciones-mamarias-en-el-periodo-de-vaca-seca-segunda-parte/» size=»large» color=»red» target=»_blank» class=»»]Lee la Segunda Parte del Artículo – Clic Aquí[/fresh_button]
* El Autor será el Profesor del Curso Vía Internet: Actualización en Mastitis Bovina 2015 que iniciará el 20 de Agosto y que puede ser tomado desde cualquier país en donde se encuentre el interesado. CLIC AQUI>>>
BIBLIOGRAFIA
- Bachman KC, Schairer ML. 2003. Bovine studies on optimal length of dry periods. J. Dairy Sci. 86:3027-3037.
- Bolourchi M, Hovareshti P, Tabatabayi AH. 1995. Comparison of the effects of local and systemic dry cow therapy for staphylococcal mastitis control. Prev. Vet. Med. 25:63-67.
- Booth JM. 1975. Mastitis control in the field: some results of two large field trials. pp. 19-31, In: Proc. Natl. Mastitis Council, Arlington, VA.
- Bramley AJ, Cullor JS, Erskine RJ, Fox LK, Harmon RJ, Hogan JS, Nickerson SC, Oliver SP, Smith KL, Sordillo LM. 1996. Current concepts of bovine mastitis, p. 64. 4th Edition, The National Mastitis Council, Madison, WI.
- Capuco AV, Akers RM, Smith JJ. 1997. Mammary growth in Holstein cows during the dry period: quantification of nucleic acids and histology. J. Dairy Sci. 80:477-487.
- Capuco AV, Akers RM. 1999. Mammary involution in dairy animals. J. Mam. Gland Biol. Neoplasia 4:137-144.
- Dallard BE, Ruffino V, Heffel S, Calvinho LF. 2007. Effect of a biological response modifier on expression of growth factors and cellular proliferation at drying off. J. Dairy Sci. 90:2229-2240.
- Dingwell RT, Leslie KE, Schukken YH, Sargeant JM, Timms LL, Duffield TF, Keefe GP, Kelton DF, Lissemore KD, Conklin J. 2004. Association of cow and quarter-level factors at drying off with new intramammary infections during the dry period. Prev. Vet. Med. 63:75-89.
- Eberhart RJ. 1986. Management of dry cow to reduce mastitis. J. Dairy Sci.69:1721-1729.
- Erskine RJ, Barlett PC, Crawshaw PC, Gombas DM. 1994. Efficacy of intramuscular oxytetracycline as a dry cow treatment for Staphylococcus aureus mastitis. J Dairy Sci 77:3347-3353.
- Erskine RJ, Barlett PC, Tavernier SR, Fowler RH, Walker RD, Seguin JH, Shuster D. 1998. Recombinant bovine interleukin-2 and dry cow therapy: efficacy to cure and prevent intramammary infections, safety, and effect on gestation. J Dairy Sci 81:107-115.
- Fox LK, Gay JM. 1993. Contagious mastitis. Vet. Clin. North America: Food Anim. Pract. 9:475-487.
Holst BD, Hurley WL, Nelson DR. 1987. Involution of the bovine mammary gland: histological and ultrastructural changes. J. Dairy Sci. 70:935-944.
- Huxley JH, Green MJ, Green LE, Bradley AJ. 2002. Evaluation of the efficacy of an internal teat sealer during the dry period. J. Dairy Sci. 85:551-561.
- Jánosi S, Huszenicza G. 2001. The use of the dry cow therapy in the control of bovine mastitis. Vet. Med. –Czech 46:55-60
- Nickerson SC, Owens WE, Fox LK, Scheifinger CC, Shryock TR, Spike TE. 1999. Comparison of tilmicosin and cephaprinin as therapeutics for Staphylococcus aureus mastitis at dry-off. J. Dairy Sci. 82:696-703.
- Oliver SP and Smith KL 1982. Nonantibiotic approach in control of bovine mastitis during dry period Journal of Dairy Science 65:2119-2124.
- Oliver SP, Sordillo LM. 1988. Udder health in the periparturient period. J. Dairy Sci. 71:2584-2606.
- Sandholm M, Pyörälä S. 1995. Dry cow therapy. In: The bovine udder and mastitis. M. Sandholm, T. Honkanen-Buzalski, L. Kaartinen and S. Pyörälä (Eds.). University of Helsinki, Faculty of Veterinary Medicine. Helsinki. Pp.209-214.
- Sanford CJ, Keefe GP, Dohoo IR, Leslie KE, Dingwell RT, DesCôteaux L, Barkema H. 2006. Efficacy of using an internal teat sealer to prevent new intramammary infections in nonlactating dairy cattle. JAVMA 228:1565-1573.
- Smith KL, Hogan JS. 1997. Risk factors for environmental streptococcal intramammary infections. In: Proc. Symp. Udder Health Management for envirronmental streptococci. June 2nd. Ontario Veterinary College, Canada. Pg. 42-50.
- Soback S. 1988. Therapeutic success or failure in mastitis therapy – A pharmacokinetic approach. Isr. J. Vet. Med. 44:233-243.
- Soback S, Ziv G, Winkler M, Saran A. 1990. Systemic dry cow therapy – A preliminary report. J. Dairy Sci. 73:661-666.
- Sol J, Harinken J, van Uum A. 1990. Factors affecting the result of dry cow treatment. In: Proc. Int. Symp. Bovine Mastitis, Indianapolis. Natl. Mastitis Counc. Arlington, VA. Pg. 118.
- Sordillo LM, Nickerson SC. 1988. Morphologic changes in the bovine mammary gland during involution and lactogenesis. Am. J. Vet. Res. 49:1112-1120.
- Tarabla HD. 1996. Importancia de la sensibilidad de la prueba diagnóstica y de la prevalencia de patógenos intramamarios en el tratamiento selectivo de la vaca seca. Memorias Congr. Nac. Calidad de Leche y Mastitis, Rio Cuarto, Córdoba, Pp. 21-23.
- Tarabla HD, Canavesio VR. 2003. Prevalence of intramammary infections by major pathogens at parturition in dairy cows after intramuscular antibiotic therapy at drying off: a preliminary report. J. Dairy Res. 70:233-235.
- Tonini N, Litterio N, Boggio JC, Tarabla HD, Calvinho L. 2005. Disposición plasmática y láctea de tilosina administrada por vía intramuscular en dos regímenes distintos a vacas al fin de la lactancia. XI Jornadas Latinoamericanas, XV Nacionales de Fármaco-Toxicología Veterinaria. Facultad de Agronomía y Veterinaria, UNRC, Córdoba, Abs. Pp. 96.
- Williamson JH, Woolford MW, Day AM. 1995. The prophylactic effect of a dry-cow antibiotic against Streptococcus uberis. N.Z. Vet. J. 43:228-234.
- Zecconi A, Costanzi F, Nai P, Piccinini R. 1999. Field study of intramuscular antibiotic treatment with tylosin on IMI prevalence after calving. In: Natl. Mastitis Council. 38th Ann. Mtg. Proc. Nat. Mastitis Council, Inc. Arlington, VA. Pp. 237-238.
- Zecconi A. 2000. Present and future of modulation of mammary gland immunity. In: Proc. IDF Symposium of Immunology of Ruminant Mammary Gland. Stressa. A Zecconi (ed.). p. 397-402.
- Ziv G., Saran-Rosenzuaig A, Gluckmann E. 1973. Kinetic considerations of antibiotic persistence in the udders of dry cows. Zbl. Vet. Med. B 20:425-434.
- Ziv G, Gordin S, Bechar G, Bernstein S. 1976. Binding of antibiotics to dry udder secretions and to udder tissue homogenates. Br. Vet. J. 132:318-322.
- Ziv G. 1980. Practical pharmacokinetics aspects of mastitis therapy. Vet. Med. Small Anim. Clin. 75(2,3 &4): 270-290; 469-474; 657-671.
- Ziv G. 1992. Treatment of peracute and acute mastitis.-Veterinary clinics of North América Food animal practice.8:1-14.
- Ziv G, Storper M, Saran A. 1981. Comparative efficacy of three antibiotic products for the treatment and prevention of subclinical mastitis during the dry period. Vet. Q. 3:74-79.

 Artículos10 meses atrás
Artículos10 meses atrás
 Artículos11 meses atrás
Artículos11 meses atrás
 Noticias Nacionales10 meses atrás
Noticias Nacionales10 meses atrás
 Giras1 año atrás
Giras1 año atrás
 Cursos A Distancia1 año atrás
Cursos A Distancia1 año atrás
 Noticias Nacionales5 meses atrás
Noticias Nacionales5 meses atrás
 cursos on line10 meses atrás
cursos on line10 meses atrás
 Noticias Nacionales1 año atrás
Noticias Nacionales1 año atrás